Zur Behandlung chronischer Insomnie
Gute Nacht.
Guten Tag.
QUVIVIQ™ wird angewendet zur Behandlung von Erwachsenen mit Schlafstörungen (Insomnie), deren Symptome seit mindestens 3 Monaten anhalten und eine beträchtliche Auswirkung auf die Tagesaktivität haben.1
Die Fachinformation finden Sie über die Schaltfläche ‚FI‘ rechts.
Mit QUVIVIQ™ 50 mg - abends, einmal pro Nacht - können Sie Ihren Patient:innen mit chronischer Insomnie helfen:
❋ Körperliche Abhängigkeit wurde nach 12 Monaten in einer klinischen Studie bewertet.1
† Mit QUVIVIQ haben Ihre Patient:innen mit chronischer Insomnie eine Behandlungsoption, deren Behandlungsdauer bei Bedarf zeitlich nicht begrenzt ist – jedoch sollte die Behandlungsdauer so kurz wie möglich sein und deren Notwendigkeit in regelmäßigen Abständen überprüft werden.1
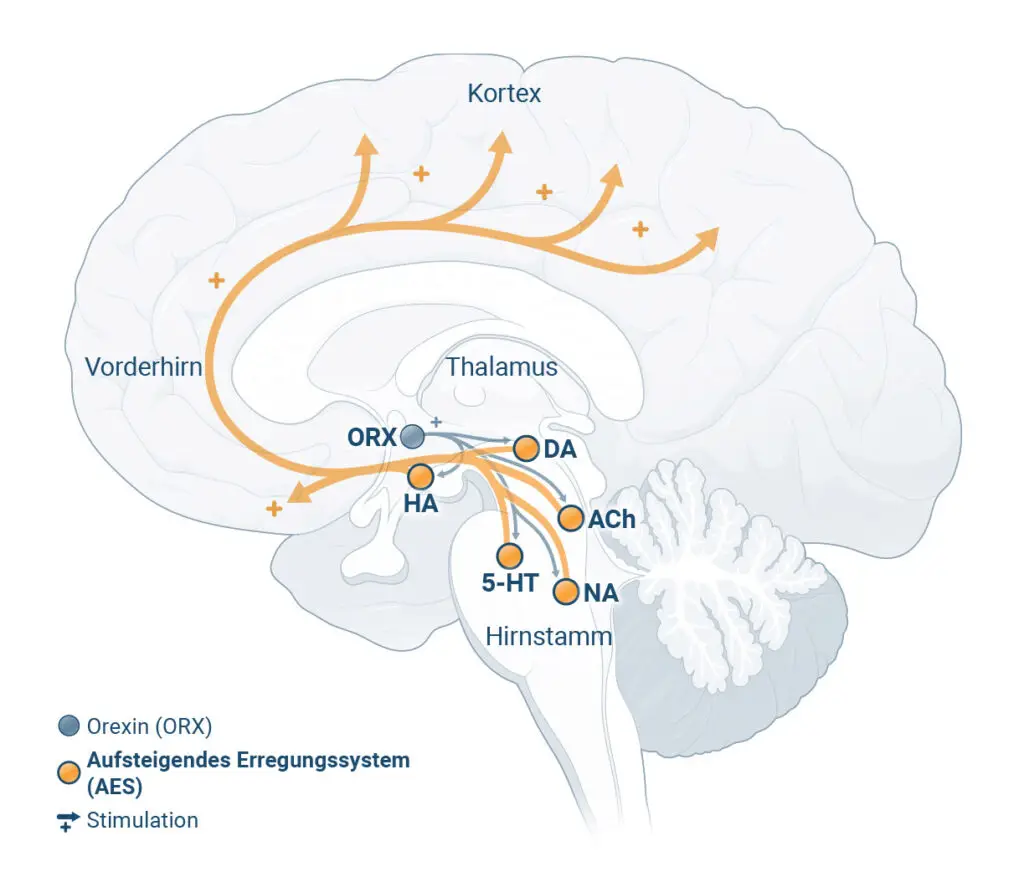
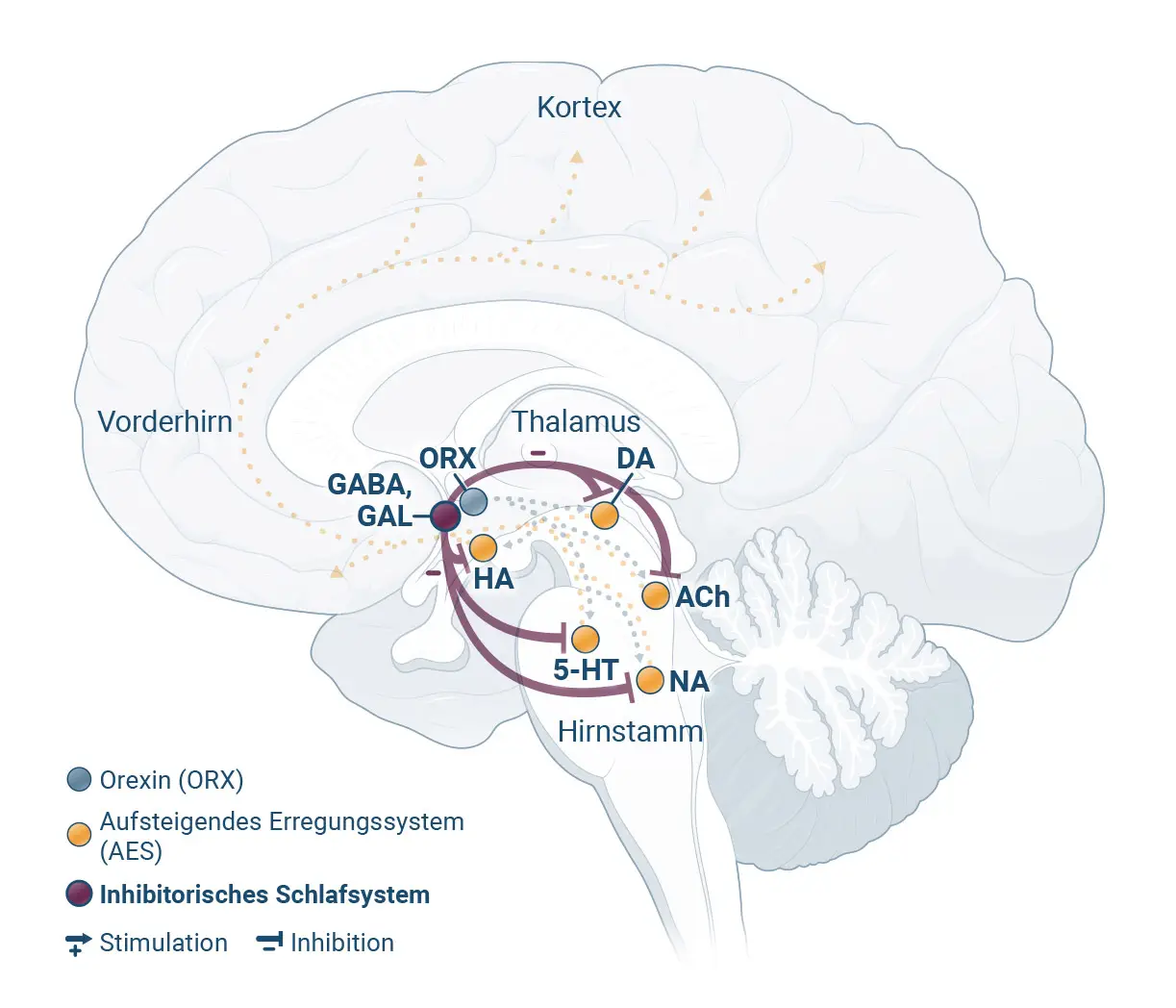
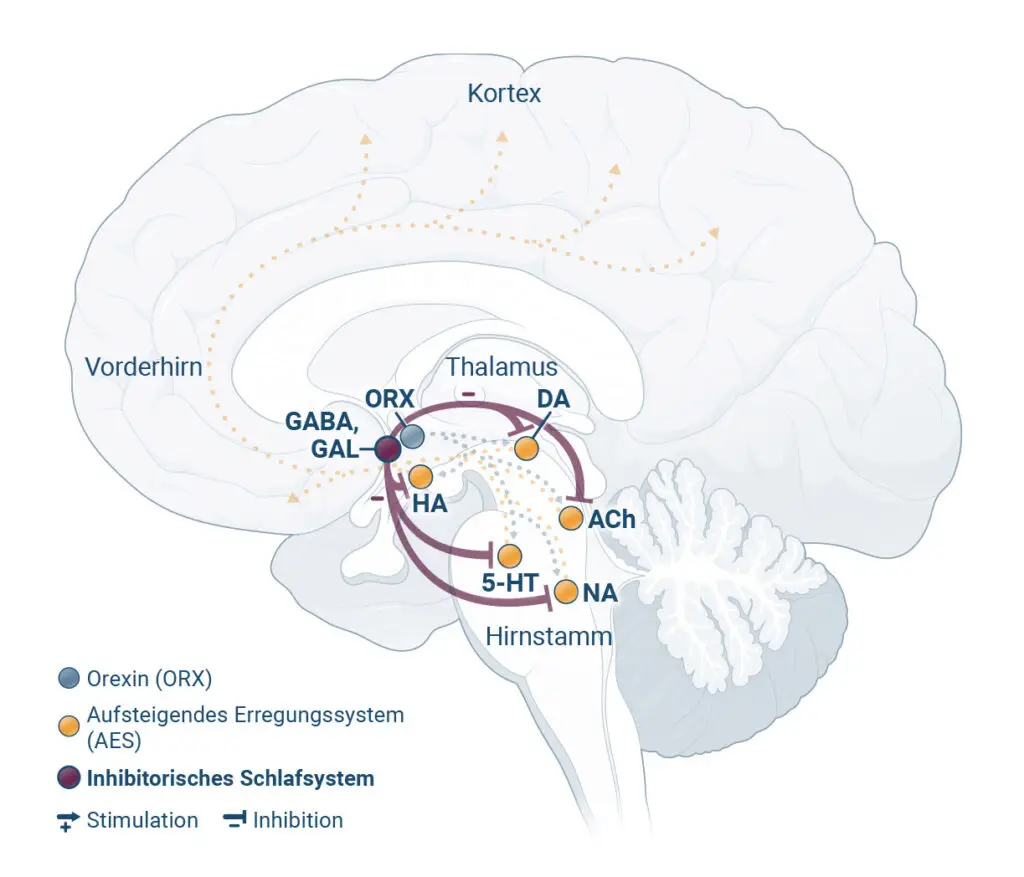
Patient:innen mit chronischer Insomnie leiden nachts häufig unter einem Hyperarousal4
Forschungsergebnisse deuten darauf hin, dass die wachmachenden Regionen des Gehirns bei chronischer Insomnie nachts überaktiv bleiben. Diesen Zustand bezeichnet man als „Hyperarousal“.4,5
Orexin ist ein Neurotransmitter, der den Wachzustand fördert und somit ein spezifisches Ziel für Interventionen darstellt.2
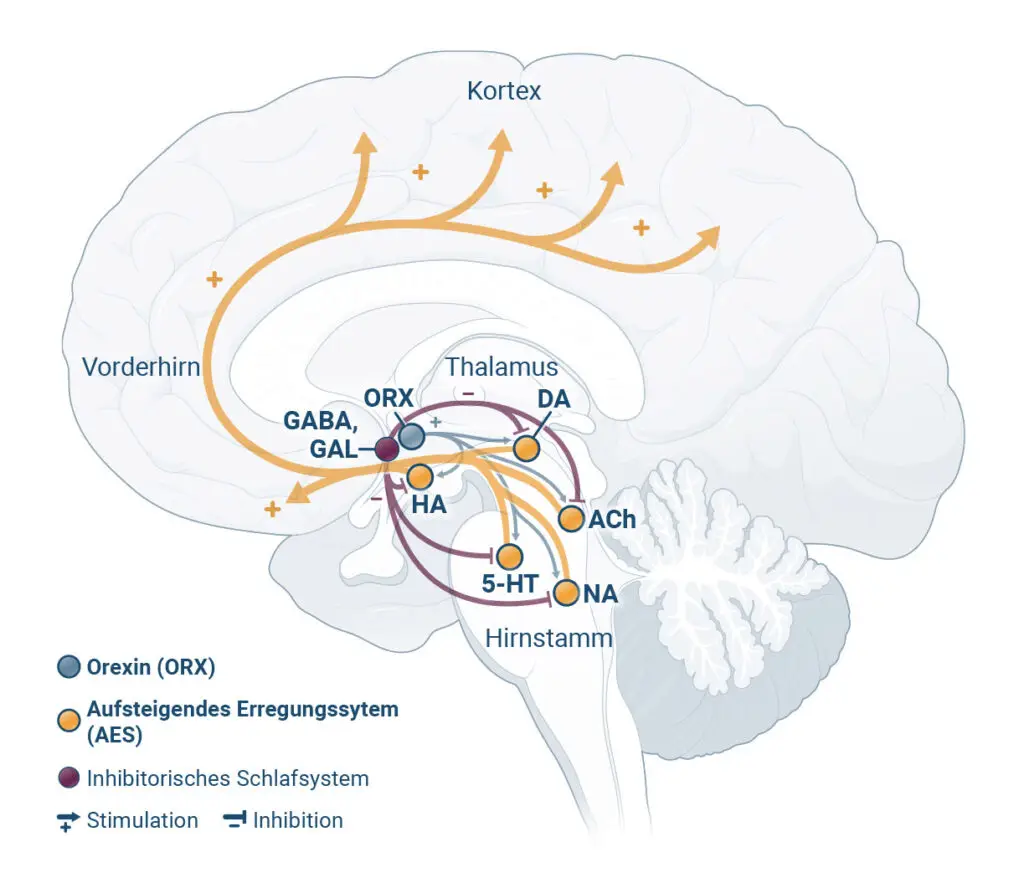
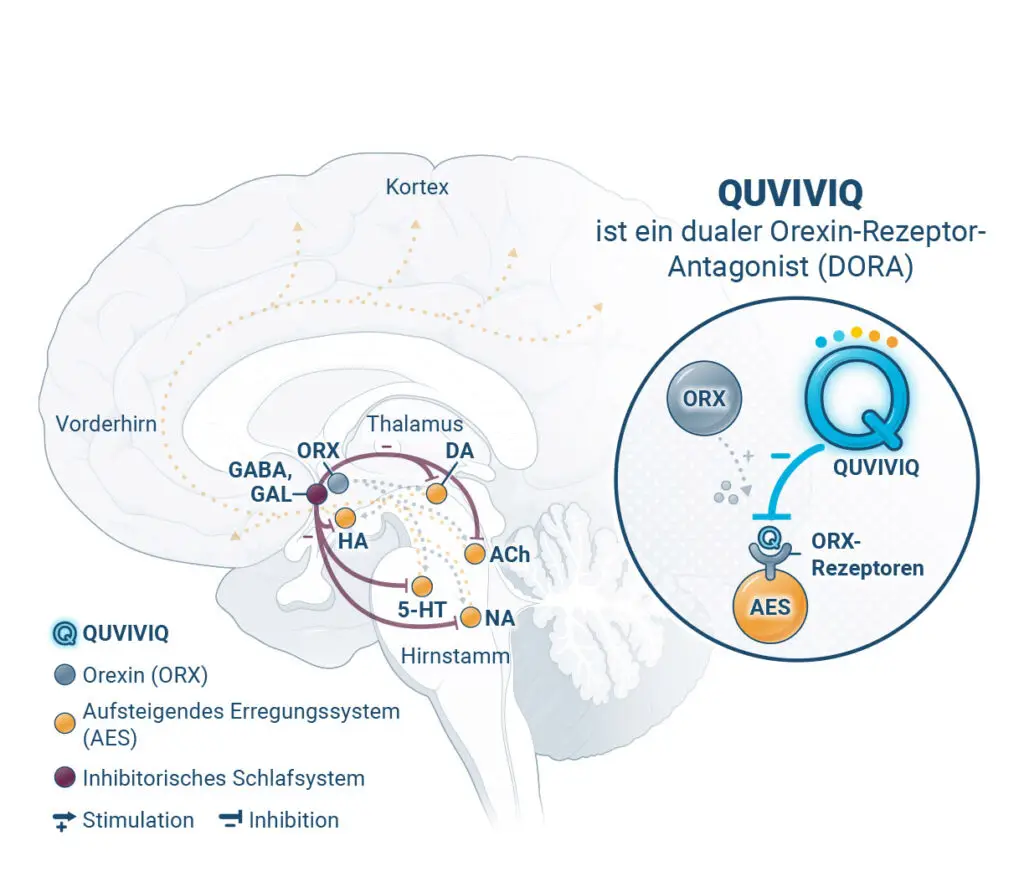
Haftungsausschluss: Diese Darstellung zeigt repräsentativ die beschriebenen Zustände im Gehirn und die wichtigsten beteiligten Hirnregionen. Sie erheben nicht den Anspruch, alle beteiligten Hirnregionen vollständig abzubilden.
QUVIVIQ reduziert durch Blockierung der Orexin-Rezeptoren die Wachheit, was das Einschlafen erleichtert, ohne das Verhältnis der Schlafphasen* zu verändern2,6
Die regelmäßige nächtliche Einnahme von QUVIVIQ™ 50 mg bewirkte in der Zulassungsstudie:3
Schnelleres Einschlafen
(gemessen im Schlaflabor)
Patient:innen
schlafen
about
Minuten
schneller ein…
Weniger Wachzeiten
(gemessen im Schlaflabor)
… sind nachts
about
Minuten
weniger wach…
Längere Gesamtschlafdauer
(patientenberichtet)
… schlafen
pro Nacht
about
Stunde
länger…
Bessere Tage‡
(patientenberichtet)
… und fühlen sich am nächsten Tag
wacher und aktiver
‡ Die Daten beziehen sich auf die Schläfrigkeits-Domäne des IDSIQ.
Gute Nacht.
Wirksamkeit in der Nacht
Guten Tag.
Wirksamkeit am Tag
Wirksamkeit in der Nacht
Schnelleres Einschlafen (gemessen im Schlaflabor):§3
§ Primärer Endpunkt: Einschlaflatenz (LPS); objektive Veränderung vom Ausgangswert zu Monat 1 und 3.3
Weniger Wachzeiten (gemessen im Schlaflabor):||3
|| Primärer Endpunkt: Wachphasen nach Schlafbeginn (WASO); objektive Veränderung vom Ausgangswert zu Monat 1 und 3.3
Längere Gesamtschlafdauer (patientenberichtet):¶3
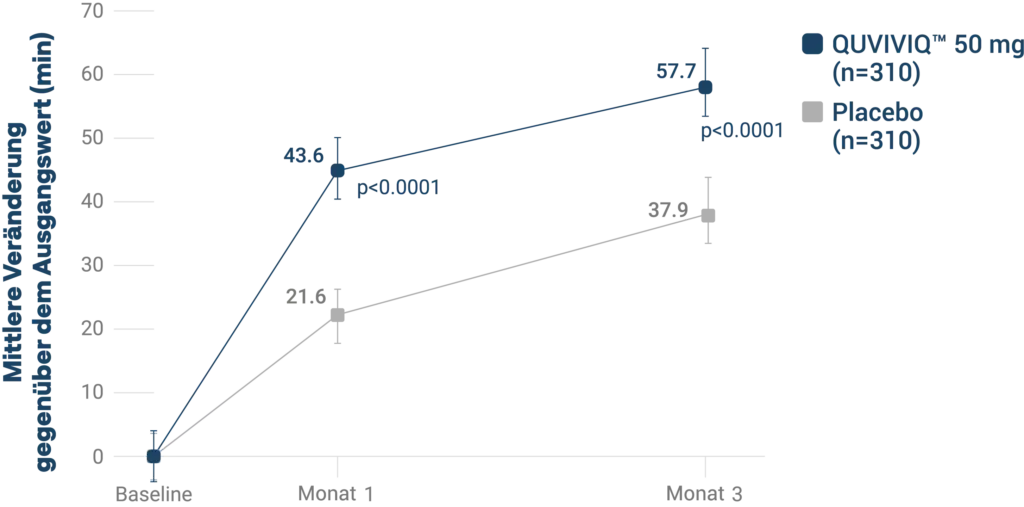
¶ Sekundärer Endpunkt: empfundene Gesamtschlafdauer; Veränderung vom Ausgangswert zu Monat 1 und 3.3
Patient:innen schliefen zu Monat 3
jede Nacht etwa eine Stunde länger
Im Vergleich zum Ausgangswert
entspricht dies rechnerisch einer
zusätzlichen Nacht Schlaf pro Woche.3
Wirksamkeit am Tag
Verbesserung der Tagesaktivität (IDSIQ):**3
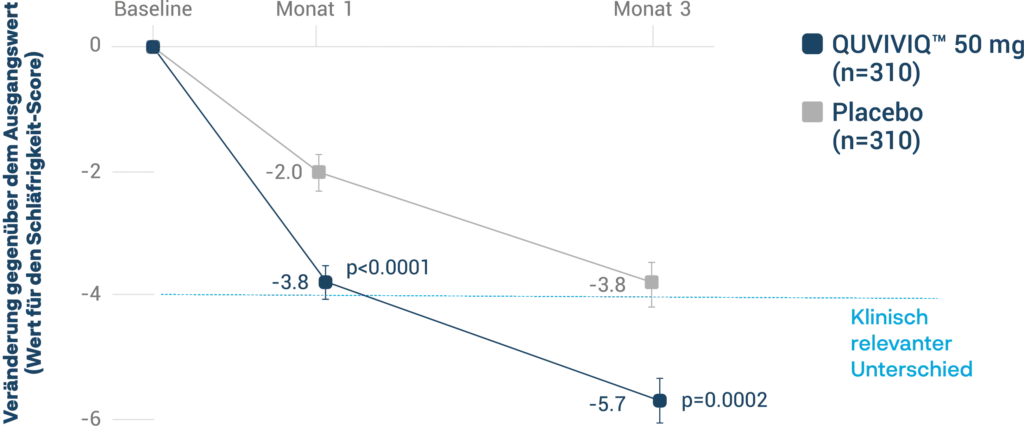
** Sekundärer Endpunkt: Insomnia Daytime Symptoms and Impacts Questionnaire (IDSIQ) Score der Schläfrigkeits-Domäne; Veränderung vom Ausgangswert zu Monat 1 und 33
Mit QUVIVIQ 50 mg
fühlten sich
Patient:innen zu Monat 3 tagsüber weniger
müde, weniger schläfrig
und stattdessen
energiegeladener
gegenüber dem Ausgangswert.
QUVIVIQ ist eine Behandlungsoption der nächsten Generation - QUVIVIQ verbesserte in klinischen Studien sowohl die Schlafquantität und -qualität von Patient:innen als auch die Tagesaktivität (patientenberichtet).3
© 2020, Universität von Pittsburgh. Alle Rechte vorbehalten. IDSIQ-14 wurde 2020 von Idorsia Pharmaceuticals Ltd lizensiert und von Idorsia Pharmaceuticals Ltd unter Lizenz vertrieben. IDSIQ ist eine eingetragene Marke von Idorsia Pharmaceuticals Ltd
Entwickelt von Buysse et al., University of Pittsburgh, und geändert von Idorsia Pharmaceuticals Ltd.
Bieten Sie Ihren Patient:innen eine Behandlungsoption, die für eine langfristige
Therapie geeignet ist1
Mit QUVIVIQ haben Ihre Patient:innen mit chronischer Insomnie eine Behandlungsoption, deren Behandlungsdauer bei Bedarf zeitlich nicht begrenzt ist.1
In klinischen Studien zeigten sich nach Absetzen von QUVIVIQ:1
Keine Anzeichen einer körperlichen Abhängigkeit, selbst bei kontinuierlicher nächtlicher Einnahme über 12 Monate
Keine Anzeichen von Missbrauch oder Entzugserscheinungen
Keine Anzeichen von
Toleranzentwicklung und Rebound-Insomnie
Die Behandlungsdauer von QUVIVIQ ist zeitlich nicht begrenzt, sollte jedoch so kurz wie möglich sein und regelmäßig neu bewertet werden.1
Bieten Sie Ihren Patient:innen eine effektive und gut verträgliche Behandlungsoption3
QUVIVIQ 50 mg macht einen Unterschied wie Tag und Nacht – mit einer niedrigen Rate unerwünschter Ereignisse vergleichbar mit Placebo. 3
Unerwünschte Ereignisse, die von ≥1% der Patienten in jeder Gruppe gemeldet wurden.3
Unerwünschtes Ereignis | QUVIVIQ 50 mg (n=308) | Placebo (n=309) |
|---|---|---|
Nasopharyngitis | 6% | 6% |
Kopfschmerzen | 6% | 4% |
Versehentliche Überdosierung | 3% | 2% |
Müdigkeit | 2% | 1% |
Schwindel | 2% | 1% |
Übelkeit | 2% | 1% |
Schläfrigkeit | 2% | 2% |
Sturz | <1% | 3% |
Infektion der oberen Atemwege | <1% | 1% |
Das Sicherheitsprofil von QUVIVIQ 50 mg bestätigte sich auch im Rahmen der Verlängerungsstudie über einen Zeitraum von bis zu 12 Monaten.1
Bitte melden Sie unerwünschte Ereignisse, die unter Einnahme von QUVIVQ bei einem Patienten/einer Patientin aufgetreten sind über die Schaltfläche ‚UE‘ auf der rechten Seite.
QUVIVIQ™ 50 mg zur Behandlung der
chronischen Insomnie –abends, vor dem
Zubettgehen, einmal pro Nacht1
QUVIVIQ™ wird angewendet zur Behandlung von Erwachsenen mit Schlafstörungen (Insomnie), deren Symptome seit mindestens 3 Monaten anhalten und eine beträchtliche Auswirkung auf die Tagesaktivität haben.1

50 mg
abends, einmal pro Nacht1
Je nach klinischer Einschätzung, bei
Patient:innen mit mäßiger
Leberfunktionsstörung oder bei gleichzeitiger
Einnnahme mäßiger CYP3A4-Inhibitoren beträgt:
die empfohlene Dosis

25 mg
abends, einmal pro Nacht1
QUVIVIQ ist kontraindiziert bei einer Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile, Narkolepsie und bei gleichzeitiger Anwendung von starken CYP3A4-Inhibitoren.1
Bei einer gleichzeitigen Anwendung von Arzneimitteln mit dämpfender Wirkung auf das zentrale Nervensystem (ZNS) ist Vorsicht geboten und es sollte eine Dosisanpassung von QUVIVIQ und/oder der anderen Arzneimittel aufgrund potenziell additiver Wirkungen in Betracht gezogen werden.1
QUVIVIQ kann zu Mahlzeiten oder unabhängig davon eingenommen werden. Wird QUVIVIQ unmittelbar nach einer großen Mahlzeit eingenommen, kann sich jedoch die Zeit bis zum Einschlafen verzögern.
Der Verzehr von Grapefruit oder Grapefruitsaft am Abend sollte vermieden werden, da dies zu einer Erhöhung des QUVIVIQ-Spiegels im Blut führen kann.1
Eine gute Schlafhygiene unterstützt die Therapie.
Bei regelmäßiger Einnahme von QUVIVIQ 50 mg, abends, einmal pro Nacht, wurde im Vergleich zum Ausgangswert eine Verbesserung aller Schlafparameter und der Tagesaktivität beobachtet.3
Bei regelmäßiger abendlicher Einnahme von QUVIVIQ 50 mg wurde im Vergleich zum Ausgangswert eine Verbesserung aller Schlafparameter und der Tagesaktivität beobachtet.3
QUVIVIQ 50mg macht einen Unterschied wie Nacht und Tag1,3
Mit QUVIVIQ – abends, einmal pro Nacht – können Sie Ihren Patient:innen helfen:1,3
Abkürzungen
FDA: Lebensmittel- und Arzneimittelbehörde (Food and Drug Administration); IDSIQ: Fragebogen zu Symptomen und Auswirkungen von Insomnie am Tag (Insomnia Daytime Symptoms and Impacts Questionnaire); LPS: Einschlaflatenz (Latency to persistent sleep); LSM: Mittelwert der kleinsten Quadrate (least square means); SEM: Standardfehler des Mittelwerts, (standard error of the mean); sTST: von Patient:innenen empfundene Gesamtschlafdauer (Self-reported Total Sleep Time); UE, Unerwünschtes Ereignis; WASO: Gesamtdauer der Wachphasen nach Schlafbeginn (Wake After Sleep Onset); ZNS: Zentrales Nervensystem;
Referenzen
- QUVIVIQ™ Fachinformation, aktueller Stand
- Roch C, et al. Psychopharmacology. 2021; 238(10): 2693–2708.
- Mignot E, et al. Lancet Neurol. 2022. 21(2); 125–139.
- Riemann D, et al. Sleep Med Rev. 2010; 14(1): 19–31.
- Nofzinger E, et al. Am J Psychiatry. 2004; 161: 2126–2129.
- Chaput JP, et al. Nat Sci Sleep. 2018; 10: 421–430.
- Saper C, et al. Nature. 2005; 437(7063): 1257–1263.
- Janto K, et al. J Clin Sleep Med. 2018; 14(8): 1399–1408.
- Saper C, et al. Trends in Neurosc. 2001; 24(12): 726–731.
- Reimann D, et al. Lancet Neurol. 2015; 14: 547–558.
- Buysse D, et al. Drug Discov Today Dis Models. 2011; 8(4): 129–137.
- Mignot E, et al. Lancet Neurol. 2022. 21(2); 125–139. Supplementary Appendix.
- Hudgens S, et al. Patient. 2021; 14(2): 249–268.
DE-DA-00228 | Erstellungsdatum August 2023
Copyright © 2023 Idorsia Pharmaceuticals (Germany) GmbH